نقص ایمنی شدید مرکب
نقص ایمنی مرکب شدید (severe combined immunodeficiency) وابسته به ZAP70 یا SCID وابسته به ZAP70 یک بیماری ارثی می باشد که به سیستم ایمنی آسیب می رساند. SCID وابسته به ZAP70 یکی از شدیدترین انواع نقص ایمنی مرکب شدید (گروهی از اختلالات با علل ژنتیکی متعدد) می باشد. کودکان مبتلا به SCID تقریبا تمام محافظت ایمنی دربرابر باکتری ها، ویروس ها و قارچ ها را از دست می دهند. آنها مستعد ابتلا به عفونت های مکرر و مقاوم می باشند که می توانند بسیار جدی یا تهدید کننده حیات باشند. معمولا ارگانیسم هایی که باعث ایجاد عفونت در افراد مبتلا به این بیماری می شوند، با عنوان فرصت طلب نامیده می شوند، به این دلیل که آنها باعث ایجاد عفونت در افراد سالم نمی شوند. نوزادان مبتلا به SCID، پنومونی، اسهال مزمن و بثورات پوستی گسترده را تجربه می کنند. آنها همچنین بسیار آهسته تر از کودکان سالم رشد می کنند. درصورت عدم درمان برای بازسازی عملکرد سیستم ایمنی، کودکان مبتلا به SCID معمولا تنها 1 الی 2 سال زنده می مانند.
اغلب افراد مبتلا به SCID وابسته به ZAP70 در طی 6 ماه اول زندگی شناسایی می شوند. حداقل 1 نفر علائم بیماری را اولین بار به طور دیررس در کودکی بروز داده و علائمی با شدت کمتر شامل عفونت های مکرر تنفسی و پوستی داشته است.
شیوع
SCID وابسته به ZAP70 یک بیماری نادر می باشد. تنها در حدود 20 بیمار مبتلا شناسایی شده است. شیوع SCID ناشی از تمام علل ژنتیکی در حدود 1 در 50.000 می باشد.
تغییرات ژنتیکی
همانطور که از اسم آن مشخص می شود، این بیماری در اثر جهش های ژن ZAP70 ایجاد می شود. ژن ZAP70 دستورالعمل ساخت پروتئینی به نام پروتئین کیناز وابسته به زنجیره زتا (zeta-chain-associated protein kinase) را فراهم می کند. این پروتئین بخشی از مسیر پیام رسانی می باشد که تکامل و فعال شدن سلول های سیستم ایمنی به نام T cell را هدایت می کند. T cell ها مواد بیگانه را شناسایی کرده و از بدن در برابر عفونت ها دفاع می کند.
ژن ZAP70 برای تکامل و عملکرد چندین نوع از T cell ها مهم می باشد. این سلول ها شامل سلول های T سیتوتوکسیک (CD8+ T cell) می باشد که عملکرد آنها تخریب سلول های آلوده به ویروس می باشد. ژن ZAP70 همچنین در فعال سازی سلول های T کمکی (CD4+ T cell) نقش دارد. این سلول ها با تاثیر بر فعالیت سایر سلول های سیستم ایمنی، عملکرد سیستم ایمنی را تنظیم می کنند.
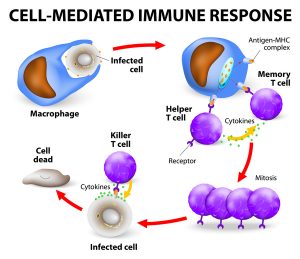
عملکرد سلول های T برای مبارزه با عفونت و از بین بردن سلول های آلوده به میکروب
جهش های ژن ZAP70 از تولید پروتئین کیناز وابسته به زنجیره زتا جلوگیری کرده یا منجر به تولید پروتئینی می شود که ناپایدار بوده و نمی تواند عملکرد خود را انجام دهد. پروتئین کیناز وابسته به زنجیره زتا فاقد عملکرد منجر به فقدان سلول های T سیتوتوکسیک و ازدیاد سلول های T کمکی غیر فعال می شود. کمبود سلول های T فعال باعث می شود که افراد مبتلا به SCID وابسته به ZAP70 بیشتر مستعد ابتلا به عفونت ها باشند.
ژن ها
ZAP70
الگوی وراثتی
این بیماری با الگوی وراثت اتوزومال مغلوب به ارث می رسد، به این معنی که هر دو نسخه ژن در هر سلول دارای جهش می باشند. والدین فرد مبتلا به یک بیماری اتوزومال مغلوب هر یک ناقل یک نسخه جهش یافته از ژن می باشند، اما آنها به طور معمول علائم و نشانه های بیماری را بروز نمی دهند.
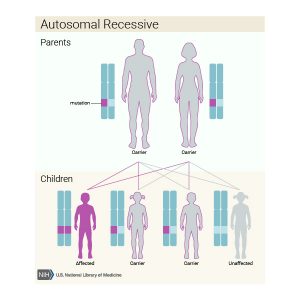 الگوی وراثت اتوزومال مغلوب
الگوی وراثت اتوزومال مغلوب
نام های دیگر بیماری
selective T-cell defect
ZAP70-related SCID
zeta-associated protein 70 deficiency
منبع: خانه ژنتیک ایران

 فعالیت آزمایشگاهی
فعالیت آزمایشگاهی