سندرم تریکوهپاتوانتریک

سندرم تریکوهپاتوانتریک (Trichohepatoenteric syndrome)، بیماری است که مو (thrico-)، کبد (hepato) و روده (enteric) و همچنین سایر بافت ها و ارگان های بدن را درگیر می کند. این بیماری همچنین به دلیل آنکه اسهال مزمن و مقاوم به درمان یکی از ویژگی های اصلی آن می باشد، با عنوان اسهال سندرمیک نیز شناخته می شود. نوزادان مبتلا در طی چند هفته اول زندگی، به اسهال آبکی مبتلا می شوند که چندین بار در روز اتفاق می افتد. حتی با وجود انجام حمایت تغذیه ای از طریق تغذیه وریدی (parenteral nutrition)، اغلب این کودکان دچار عقب ماندگی رشد می شوند، به این معنی که به میزان قابل انتظار وزن نمی گیرند یا رشد نمی کنند. اغلب کودکان مبتلا به این بیماری در زمان تولد کوچک بوده و در طی زندگی نسبت به همسالان خود کوتاه تر باقی می مانند.
موهای غیر طبیعی یکی دیگر از ویژگی های سندرم تریکوهپاتوانتریک می باشد. موهای افراد مبتلا به صورت پشم مانند، شکننده و تکه تکه توصیف می شود. در زیر میکروسکوپ چند تار مو ممکن است قطر های مختلفی با مقاطع ضخیم تر یا نازک تر باشند. به این مشخصه trichorrhexis nodosa گفته می شود.
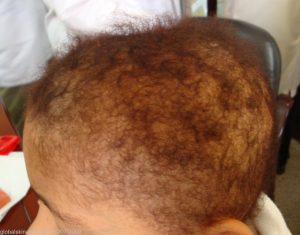
ناهنجاری مو به صورت موهای پشم مانند، شکننده و تکه تکه در بیمار مبتلا به سندرم تریکوهپاتوانتریک
سایر علائم و نشانه های سندرم تریکوهپاتوانتریک می تواند شامل بیماری کبدی، ناهنجاری های پوستی، ویژگی های مشخصه صورت شامل پیشانی عریض، بینی پهن و فاصله زیاد بین چشم ها باشد. به طور کلی ویژگی های چهره با عنوان خشن (coarse) توصیف می شوند. اغلب افراد مبتلا همچنین مبتلا به ناهنجاری های سیستم ایمنی می باشند که آنان را نسبت به ابتلا به عفونت ها مستعد می نماید. با شیوع کمتر، سندرم تریکوهپاتوانتریک با ناهنجاری های قلبی همراه می باشد. ناتوانی ذهنی خفیف در حدود نیمی از کودکان مبتلا به این بیماری گزارش شده است.
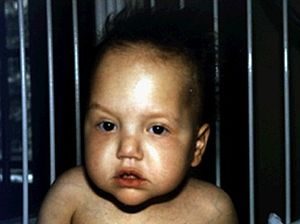
ویژگی های چهره به صورت پیشانی عریض، بینی پهن و فاصله زیاد بین چشم ها در کودک مبتلا به سندرم تریکوهپاتوانتریک
سندرم تریکوهپاتوانتریک معمولا در کودکان به خصوص کودکانی که به بیماری کبدی یا عفونت های شدید دچار می شوند، تهدید کننده حیات می باشد.
شیوع
سندرم تریکوهپاتوانتریک یک بیماری نادر بوده و شیوع آن در حدود 1 در هر 1 میلیون نفر تخمین زده می شود. حداقل 44 مورد مبتلا در مقالات علمی گزارش شده اند.
تغییرات ژنتیکی
سندرم تریکوهپاتوانتریک می تواند در اثر جهش های ژن های TTC37 و SKIV2L ایجاد شود. این ژن ها دستورالعمل تولید پروتئین هایی را فراهم می کنند که عملکرد آنها تائید نشده است. دانشمندان تصور می کنند که این پروتئین ها با هم و با پروتئین های دیگر در داخل سلول برای شناسایی وتخریب مولکول های RNA پیام رسان (mRNA) مازاد یا غیرطبیعی همکاری می کنند. mRNA یک خویشاوند شیمیایی DNA می باشد که به عنوان یک نسخه رونویسی شده ژنتیکی برای تولید پروتئین به کار می رود. مطالعات پیشنهاد می کنند که از بین بردن mRNA مازاد یا غیر طبیعی برای رشد سلولی بسیار مهم می باشد.
جهش در ژن های TTC37 و SKIV2L احتمالا عملکرد پروتئین های تولید شده از این ژن ها را که بر اساس فرضیه، mRNA مازاد را تخریب می کند، از بین می برند. هرچند که هنوز مشخص نیست که چگونه این تغییرات می تواند به اسهال مزمن و سایر مشخصات سندرم تریکوهپاتوانتریک را ایجاد می کند.
ژن ها
TTC37, SKIV2L
الگوی وراثتی
این بیماری با الگوی وراثت اتوزومال مغلوب به ارث می رسد، به این معنی که هر دو نسخه ژن در هر سلول دارای جهش می باشند. والدین فرد مبتلا به یک بیماری اتوزومال مغلوب هر یک ناقل یک نسخه جهش یافته از ژن می باشند، اما آنها به طور معمول علائم و نشانه های بیماری را بروز نمی دهند.
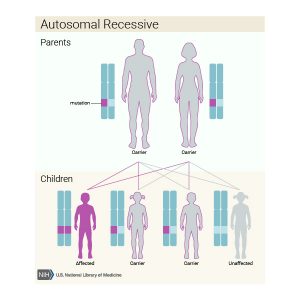
الگوی وراثت اتوزومال مغلوب
نام های دیگر بیماری
diarrhea, fatal infantile, with trichorrhexis nodosa
diarrhea, syndromic
intractable diarrhea with phenotypic anomalies
phenotypic diarrhea of infancy
SD/THE
syndromic diarrhea
THE syndrome
THES
tricho-hepato-enteric syndrome



 فعالیت آزمایشگاهی
فعالیت آزمایشگاهی