شکل بیوشیمیایی prot S

Protein C Activity
مخفف انگلیسی تست
Pr C
نام فارسی تست
پروتئین C
نام های دیگر
Protein C Activity, Plasma
روش انجام
(chromogenic peptide substrates) Chromogenic
آمادگی بیمار
* از Warfarine ، coumadin، Estrogen 10 روز قبل از نمونه گیری استفاده نشود.
** در صورت امکان بیمار ناشتا باشد.
ملاحظات نمونه گیری
۱- نمونه های خارج از آزمایشگاه باید فوراً جهت انجام آزمایش یا فریز نمونه به آزمایشگاه فرستاده شود.
۲- نمونه در کمترین زمان ممکن باید سانتریفیوژ گشته و پلاسما از سلول جدا گردد.
۳- به علت آلودگی پلاکتی و ایجاد تداخل در نتایج آزمون بهتر است نمونه دوبار سانتریفوژ گردد.
۴- برای سنجش آزمون از لوله های مخصوص به نمونه استفاده کنید و از انتقال نمونه به لوله دیگر اجتناب کنید.
۵- بهتر است خون ابتدایی گرفته شده برای اندازه گیری پروتئین C استفاده نشود؛ زیرا نمونه اولیه ممکن است حاوی ترومبوپلاستین بافتی باشد و در نتایج آزمون تداخل نماید.
۶- هر گونه داروی مؤثر بر نتایج آزمون را در برگه آزمایش یادداشت نمایید.
نوع نمونه
PC
علت درخواست تست
توضیح راجع به تست
پس از اتمام پروسه انعقاد؛ مقادیر اضافی فاکتورهای انعقادی توسط مهار کننده های فیبرینی نظیر آنتی پلاسمین، آنتی ترومیبین III و پروتئین C غیر فعال می شوند. این اتفاق از ایجاد غیر ضروری لخته در آینده جلوگیری بعمل می آورد.
پروتئین C؛ پروتئینی است که در کبد ساخته می شود و در پلاسما در گردش است. وجود ویتامین K برای عملکرد آن ضروری می باشد. پروتئین C به علت غیر فعال کردن فاکتور های ۵ و ۸؛ یک ضد انعقاد در بدن محسوب می شود. همچنین پروتئین S کوفاکتوری است که اثر ضد انعقادی پروتئین C را بیشتر می کند.
تست پروتئین C برای بیماران دچار عود ترومبوز؛ انجام می شود. وقتی که سطح پروتئین C پایین باشد؛ بیمار در معرض خطر ترمبوز عروقی قرار دارد.
در چه شرایطی تست کاهش می یابد؟
همچنین در این موارد هم ممکن است پروتئین C کاهش یابد:
تست های تکمیلی
Factor V Leiden; Prothrombin 20210; Homocysteine; Lupus Anticoagulant Testing; Antithrombin Activity
تداخلات دارویی و آزمایشگاهی
دسموپرسین ، ضد بارداری های خوراکی و استانُزولول باعث افزایش سطح پروتئین C می شوند.
کومارین و وارفارین (کومادین)، آنتی بیوتیک ها، آسپارژیناز، استروژن ها، هپارین سطح پروتئین C را کاهش می دهند.
نکته ۱: نمونه های لیپمیک (TG > 890 mg/dl)، سطح بالای فاکتور ۸ انعقادی (>300%)، بیلی روبین بالا (> 21 mg/dl) موجب کاهش کاذب فعالیت پروتئین C و کاهش نتیجه آزمایش می گردد.
نکته ۲: بارداری باعث کاهش پروتئین C می گردد.
نکته ۳: غلظت ناهمگون ضد انعقاد سیترات می تواند بر میزان فعالیت پروتئین Cاثر گذار باشد.
نکته ۴: بستن تورنیکه به مدت بیش از ۱ دقیقه ممکن است باعث اِستاز وریدی و تغییر غلظت پروتئین های پلاسما شود.
نکته ۵: نمونه های همولیز شده بدلیل فعال بودن پلاکت ها و فاکتورهای انعقادی قابل آنالیز نیستند.
اطلاعات تکمیلی
پروتئین C و S از مهارکنندگان کوفاکتورهای انعقادی ۵ و ۸ می باشند. ترومبین بعد از متصل شدن به ترمبو مدولین (به عنوان رسپتور ترومبین در سطح سلول های اندوتلیال) سبب فعال شدن پروتئین C می گردد. پروتئین C فعال شده نیز از طریق اتصال به گیرنده پروتئین C سلول اندوتلیال (ECPR)؛ سبب تجمع پروتئین C بر سطح اندوتلیال و تسهیل فعال سازی آن (APC) از طریق مجموعه ترومبین- ترمبو مدولین می گردد.
پروتئین S به عنوان کوفاکتور پروتئین C؛ باعث افزایش و بهبود عملکرد پروتئین C و انصال آن به پلاکت ها می گردد. پروتئین C فعال شده از طریق مهار کننده های سرین پروتئازی سرمی (Serpins) مانند آنتی ترومبین؛ مهار می گردد. همچنین پروتئین C به عنوان یک عامل موثر در تسهیل فیبرینولیز مطرح می باشد.
۱- چنانچه بیمار دچار کمبود پروتئین S یا C باشد؛ خانواده بیمار را نیز تشویق به انجام آزمایش کنید، زیرا آن ها نیز ممکن است دچار کمبود این پروتئین ها باشند.
۲- اختلالات کبدی، درمان با ضد انعقاد خوراکی و L-آسپارژیناز موجب کاهش سنتز کبدی پروتئین C می گردد.
۳- میزان پروتئین C اندازه گیری شده توسط روش کروموژنیک و ایمنو اَسی؛ بالاتر از مقادیر بدست آمده از روش Clot-based است.
منابع
۸- گل افشان حبیب اله. مهارت های آزمایشگاهی در خون شناسی، چاپ اول، انتشارات دانشگاه علوم پزشکی شیراز، ۱۳۹۰ .
۹- جعفر آبادی آشتیانی مهتاب و همکاران. کتاب جامع تست های تشخیصی و آزمایشگاهی پاگانا ۲۰۱۴، انتشارات جامعه نگر، ۱۳۹۴ .
۱۰- اسدی محسن. مجموعه سوالات طبقه بندی شده کارشناسی ارشد وزارت بهداشت هماتولوژی از سال ۸۵ تا ۹۴ با پاسخنامه کاملاً تشریحی و کاربردی، انتشارات اطمینان، ۱۳۹۴
الگوی الکتروفورتیک یک فرد بالغ طبیعی، تنها انواع هموگلوبینهای فیزیولوژیکی را به نمایش میگذارد که شامل HbA1 و HbF و HbA2 میشوند و غلظت آنها در رنج نرمال قرار میگیرد (جدول ۱ را ببینید). کشف باندهای غیرطبیعی، که معمولاً در الگوهای طبیعی ظاهر نمیشوند، بیانگر حضور هموگلوبینهای غیرطبیعی در نمونهی خون است – شکل ۱ را ببینید.
| نوع هموگلوبین | ترکیب زنجیرهی گلوبین | درصد نسبت به غلطت کل هموگلوبین |
| HbA یا HbA1 | α2β2 | ۹۸ – ۹۵ ٪ |
| HbA2 | α2δ2 | ۳٬۵ – ۱٬۵ ٪ |
| HbF | α2γ2 | ۲ – ۰ ٪ |
جدول ۱ – انواع هموگلوبینهای انسانی در یک فرد بالغ طبیعی
حرکت الکتروفورتیک برخی از هموگلوبینهای غیرطبیعی بیشتر از HbA1 است و از این رو به آنها «هموگلوبینهای سریع – fast hemoglobins» گفته میشود؛ از جملهی این هموگلوبینها میتوان به HbH و HbBart’s اشاره کرد.
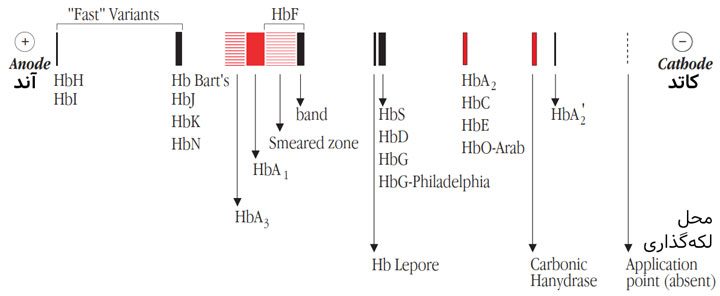 شکل ۱ – حرکت الکتروفورتیک نسبی هموگلوبینهای انسانی طبیعی و غیرطبیعی رو استات سلولز در pH قلیایی
شکل ۱ – حرکت الکتروفورتیک نسبی هموگلوبینهای انسانی طبیعی و غیرطبیعی رو استات سلولز در pH قلیایی
HbH: به شکل یک باند باریک (sharp) ظاهر میشود که موقعیت آن به آند نزدیکتر بوده و فاصلهاش تا HbA1 قابل مقایسه با فاصلهی HbA2 با HbA1 است.
HbBart’s: حرکتی در حد واسط HbA1 و HbH دارد؛ ظهور این نوع هموگلوبین در خون بند ناف امکان تشخیص حامل خاموش برای تالاسمی آلفا را فراهم میآورد.
آمادهسازی نمونه برای آنالیز یکی از معیارهای اصلی تاثیرگذار بر کیفیت الگوی الکتروفورتیک هموگلوبین است. محلول استفاده شده برای آنالیز، که به آن همولیزات گفته میشود، یک محلول مایع است که شامل هموگلوبینی است که توسط شکسته شدن غشای گلبولهای قرمز به وجود میآید.
شستشوی گلبولهای قرمز: این فرایند باعث حذف باقیماندهی سرم از سطح گلبولهای قرمز میشود و که در نتیجه پروتئینهای سرم که میتوانند بر کیفیت جداسازی باندها تاثیر بگذارند، شسته میشوند.
گلبولهای قرمز از خون تام (Whole Blood) گرفته شده و با سرم فیزیولوژی (Saline – 0.9% w/v NaCl) شستشو میشوند؛ یک حجم از گلبولهای قرمز در ۹ حجم از سالین (سرم فیزیولوژی) رقیق میشود، سپس گلبولها به آرامی در محلول معلق شده و بعد سانتریفیوژ میشوند. محلول رویی را برداشته و سالین تمیز و تازه به گلبولهای قرمز اضافه شده و دوباره سانتریفیوژ میشود. مرحلهی شستشو زمانی به پایان میرسد که محلول رویی کاملاً روشن و شفاف شود.
لیز کردن گلبولهای قرمز: این مرحله برای استخراج هموگلوبین از گلبولهای قرمز است. لیز کردن توسط شوک اسمزی به گلبولهای قرمز انجام میشود، برای مثال از آب مقطر استفاده میشود.
در واقع آب مقطر به گلبولهای قرمزِ شستهشده اضافه میشود. غلظت نهایی هموگلوبین در همولیزات باید بین ۳ تا ۴ گرم بر دسیلیتر (g/dl) باشد، از این رو حجم آب مقطر اضافهشده تابعی از غلظت هموگلوبین در نمونهی خون است. برای مثال، اگر غلظت هموگلوبین کل در خون تام برابر ۱۲ گرم بر دسیلیتر (g/dl) باشد، ۱ میلیلیتر از گلبول قرمز شستهشده، با آب مقطر به حجم ۴ میلیلیتر رسانده میشود. بعد از مرحلهی لیز کردن، محلول سانتریفیوژ شده تا باقیماندههای سلول (cell debris) حذف شوند.
نمونهبرداری از همولیزات: این مهمترین مرحلهی فرآیند است؛ نمونهبرداری صحیح در محلول حاوی هموگلوبین از آلودگی توسط باقیماندههای سلول (cell debris) پیشگیری میکند، که بر کیفیت جداسازی (migration) و در نهایت بر کیفیت الگوی الکتروفورتیک تاثیر میگذارد.
بعد از مرحلهی سانتریفیوژ کردن، محلول درون لولهی آزمایش در قسمت بالا به صورت قرمز و شفاف و در انتهای لوله معمولاً متراکم، کدر و ژلمانند ظاهر میشود. همولیزات باید از ناحیهی شفاف نمونهبرداری شود؛ به عبارتی باید از قسمت بالایی محلول. استفاده از محلول متراکم و کدر یک الگوی الکتروفورتیک لکهدار (smeared) ایجاد نموده که تشخیص باندها را دشوار میکند. گاهی اوقات محلول همولیزات به صورت یک دست شفاف و قرمز ظاهر میشود، به عبارتی دیگر هیچ تفاوت ظاهریای مشاهده نمیشود. در این مواقع نیز همولیزات باید همیشه از قسمت بالایی محلول نمونهبردای شود.
نمونهی همولیزات بهتر است در کمتر از یک ساعت پس از آمادهسازی استفاده شود. از آنجا که محلول همولیزات تنها برای زمان کوتاهی پایدار است، توصیه میشود که نمونه خون تام نگهداری شده و همولیزات در همان روز انجام آزمایش الکتروفورز، تهیه شود. جداسازی الکتروفورتیک (Electrophoretic separation) همولیزات، که در pH قلیایی با محلول بافری با یک قدرت یونی پایین انجام میشود، پروتئینهای درون گلبولهای قرمز، از جمله هموگلوبینها و یک آنزیم به نام کربنیک انهیدراز، جدا خواهند شد.
یک الگوی الکتروفورتیک از یک همولیزات طبیعی، باندهای HbA1 (نزدیکترین به آند)، HbA2 و کربنیک انهیدراز (نزدیکترین به کاتد) را نمایش خواهد داد.
کاغذ باید به صورت کامل رنگبری شود تا پسزمینهای شفاف ایجاد کند که امکان کشف باندها را سادهتر سازد. باقیماندهی ملایمی از رنگ روی پسزمینه ممکن است از تشخیص صحیح باند HbA2، که معمولاً غلظت پایینی (۲ تا ۳ درصد) دارد، یا HbF، که حتی تا ۷-۸ درصد از هموگلوبین کل هم باند واضحی تشکیل نمیدهد و تنها یک باند کشیده شده (smeared band) در سمت کاتدی HbA1 ایجاد میکند، جلوگیری کند.
در ادامه لیستی از برخی مشخصههای کیفی الگوی یک هموگلوبین طبیعی آمده است.
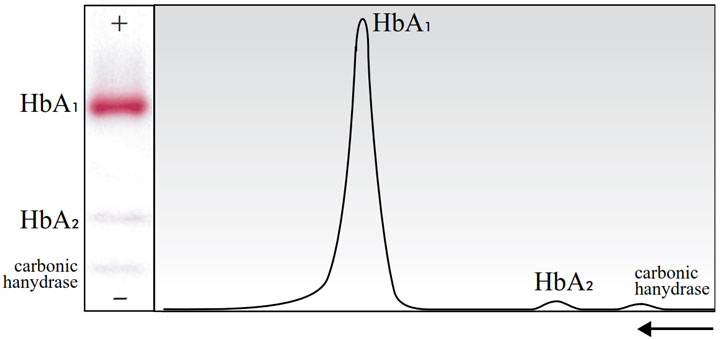
شکل ۲ – تحرک نسبی الکتروفورتیک هموگلوبین طبیعی انسان روی استات سلولز در pH قلیایی (فلش نشاندهندهی جهت حرکت است)
زمانیکه باندها تحرک الکتروفورتیک متفاوتی داشته باشند، تشخیص انواع مختلف هموگلوبین امکانپذیر است. از آنجا که هویت باندهای جداشده با توجه به مکان قرارگیری آنها در الگو، به آنها اختصاص داده میشود، الگوی نمونه با محلول هموگلوبین مرجع (نمونهی کنترل) همواره باید مقایسه شود. این محلول معمولاً شامل مخلوطی متعادل از Hbs, HbF, HbA1 و HbA2 است و امکان مقایسهی مکان هر دو نوع باندهای طبیعی و غیرطبیعی با الگوی هموگلوبین مرجع (نمونهی کنترل) را فراهم میکند. (شکل ۳ را ببینید.).
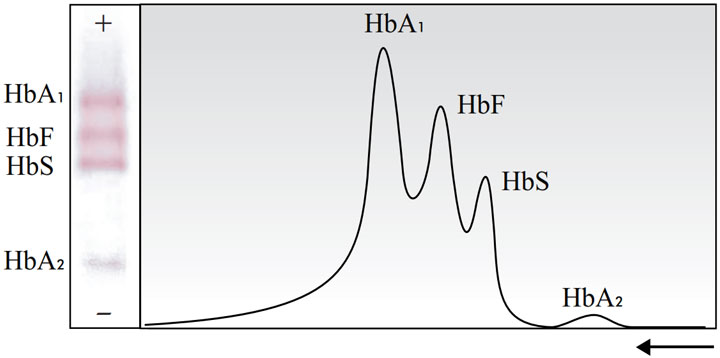 شکل ۳ – الگو و نمودار محلول کنترل برای الکتروفورز هموگلوبین
شکل ۳ – الگو و نمودار محلول کنترل برای الکتروفورز هموگلوبین
نمودار بهدست آمده از دانسیتومتری الگوی هموگلوبین برای ارزیابی کیفی، نباید هیچوقت شامل کربنیک انهیدراز باشد (شکل ۴ را ببینید.).
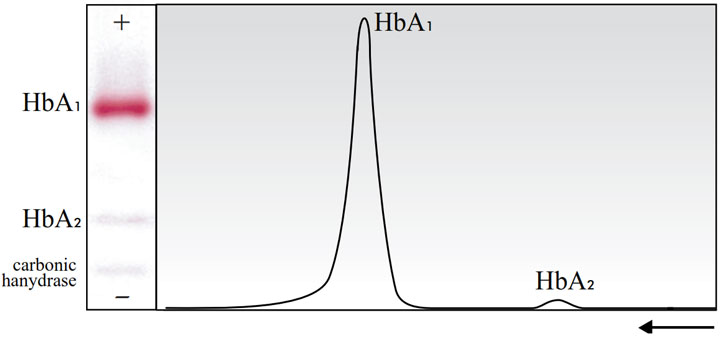
شکل ۴ – نمونهی گزارش الکتروفورز هموگلوبین
هموگلوبین F (همان HbF) در غلظتهای پایینتر از ۷-۸ درصد از هموگلوبین کل، یک باند واضح (sharp) ایجاد نمیکند، بلکه یک باند کشیده شده (smeared) که خیلی کم رنگ میگیرد را در سمت کاتدی HbA1 تشکیل میدهد.
تمرکز باند HbF با افزایش غلظت، بهبود پیدا میکند؛ از این رو، وقتی غلظت به ۱۰-۱۵ درصد برسد، یک باند واضح (sharp) در الگو مشاهده میشود، اگرچه باندهای HbA1 و HbF توسط یک ناحیهی کشیدهشده (smeared zone) به هم متصل میشوند که رنگ زیادی رو به خود میگیرد (شکل ۵ را ببینید.).
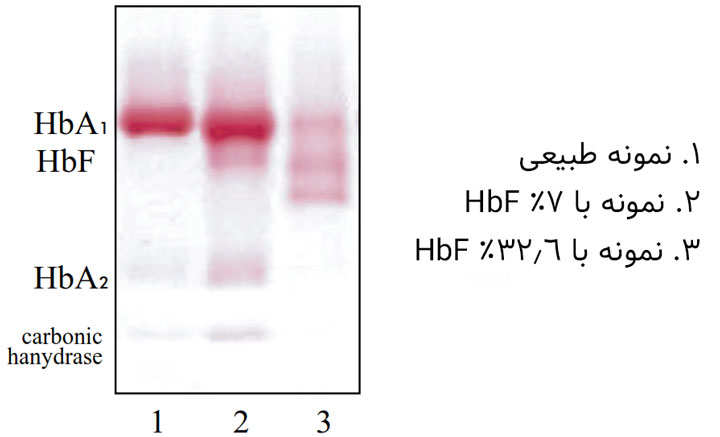 شکل ۵ – الگوی هموگلوبین F در غلظتهای مختلف
شکل ۵ – الگوی هموگلوبین F در غلظتهای مختلف
جدول ذیل، هموگلوبینهای طبیعی و غیرطبیعی را که در الگوی الکتروفورتیک براساس تحرک و/یا غلظت (که به صورت درصدی از هموگلوبین کل بیان میشود) قابل شناسایی هستند، لیست شده است.
| نوع Hb | غلظت | نکات |
| HbH
HbI |
۵ تا ۱۵ درصد
در موارد نادر ۳۰ تا ۴۰ درصد
حدود ۲۵ درصد |
باند «سریع»؛ هر دو تحرک مشابهی نشان میدهند و به یک اندازه از HbA1 فاصله میگیرند؛ برابر با فاصلهی HbA1 و HbA2 |
| Hb Bart’s | باند «سریع»؛ تحرک آن در حد فاصل HbA1 و HbH است | |
| HbJ | کمی کاتدیکتر نسبت به Hb Bart’s | |
| HbA3 | ترکیبی از هموگلوبینهای گلیکوزیله است و شبیه یک ناحیهی کشیدهشدهای که کمی رنگ گرفته، قبل از HbA1 ظاهر میشود. | |
| HbA1 | ۹۵ تا ۹۸ درصد | |
| HbF | کمتر از ۲ درصد | زمانی که غلظت آن پایین باشد، قابل تشخیص از HbA1 نیست. |
| Hb Lepore | ۱۰ تا ۱۵ درصد | کمی آندیکتر از HbS |
| HbS | ۲۵ تا ۴۵ درصد | فارغ از غلظتش، یک باند واضح و پررنگ ایجاد میکند و در حد فاصل HbA1 و HbA2 متمرکز میشود. |
| HbA2 | ۱.۵ تا ۳.۵ درصد | مقادیری بین ۳.۶ تا ۹ درصد نشانهی سندرومهای تالاسمی هستند. HbA2 به ندرت بیشتر از ۱۰ درصد میشود. مقادیر بالاتر احتمالاً ناشی از حضور HbC و HbO-Arab و HbE باشد که به اندازهی HbA2 تحرک دارند و در محل مشابه متمرکز میشوند. |
| HbA’2 | ۱.۵ تا ۳.۵ درصد | گونهی غیر پاتولوژیک HbA2 |
جدول ۲ – انواع هموگلوبینهای طبیعی و غیرطبیعی انسانی در الگوی الکتروفورتیک با توجه به تحرک و غلظت
وقتي محتواي كلي آهن بدن كاهش يابد شخص دچار كمبود آهن و هنگامي كه اين كمبود آهن به حدي باشد كه باعث كاهش خونسازي شود آنمي كمبود آهن ايجاد مي شود. آنمي كمبود آهن از اين نظر كه باعث كاهش توانائي فيزيكي بدن و كاهش رشد و يادگيري در كودكان مي شود اهميت دارد .در افراد سالم غلظت آهن بدن بدقت توسط سلولهاي جذبي قسمت پروكسيمال روده تنظيم مي شود.خطاي دائم در بالانس آهن يا باعث كمبود آهن و يا باعث هموسيدروزيس مي شود كه هركدام از آنها نتايج نامطلوبي به دنبال دارند.
اصول آزمایش
گلبولهای قرمز با فنوتیپ Du در مجاورت با آنتی D آگلوتینه نمیدهند، بلکه واکنش آنتی ژن- آنتی بادی به صورت آغشتگی (coating) است. اثبات آغشتگی گلبولهای قرمز با آنتی D به مفهوم فنوتیپ Du است، که برای این منظور از آنتیهیومن گلبولین با ویژگی ضد Fc مولکول IgG استفاده میشود. آنتی هیومن گلبولین با اتصال به مولکولهای Fc بین گلبولهای قرمز آغشته شده به آنتیکر پل زده و آنها را آگلوتینه میکند.
روش کار: توجه: برای مشاهده بهتر واکنش میتوان حجمهایی که در اینجا ذکر شده را 2 برابر کنید.
1- یک قطره آنتی D از جنس IgG یا مخلوط IgG و IgM را در یک لوله آزمایش بریزید.
2- یک قطره محلول کنترل مناسب را در لوله دیگر ریخته و نشانهگذاری کنید.
3- به هر لوله یک قطره از سوسپانسیون 2 تا 5% گلبولهای قرمز در سرم فیزیولوژی اضافه و مخلوط کنید.
4- لولهها را به مدت 15 تا 30 دقیقه در 37 درجه انکوبه کنید و پس از آن با دور 3000 در دقیقه یا g1000-900 برای 30 ثانیه سانتریفوژ کنید.
5- با مشاهده آگلوتیناسیون قوی گروه خون را ارهاش مثبت گزارش کنید و احتیاج به مراحل بعدی ندارد. لوله کنترل بایستی منفی باشد.
6- در صورت مشاهده واکنش منفی یا مشکوک در لوله تست آن را 3 الی 4 بار با سرم فیزیولوژی شسته و در مرحله آخر شستشو بعد از دور ریختن سرم فیزیولوژی با واژگون کردن لوله آزمایش روی پارچه گاز آخرین قطرات سرم فیزیولوژی را جذب گاز کنید.
7- یک تا دو قطره آنتی هیومن گلبولین را به لوله آزمایش اضافه کرده و بمدت 15 ثانیه سانتریفوژ کنید.
8- لوله را باتکان دادن ملایم برای آگلوتیناسیون مشاهده کنید. مشاهده واکنش آگلوتیناسیون به مفهوم فنوتیپDu است.
9 چنانچه واکنش منفی بوده و از کارآیی آنتی هیومن گلبولین مطمئن هستید جواب را ارهاش منفی گزارش کنید.
چند نکته:
- انجام تست Du برای تمام اهدا کنندگان خون که در مرحله تست فوری با آنتی D جواب منفی میدهند لازم است.
- انجام تست Du برای نوزادی که مادر دارای گروه ارهاش منفی است لازم است. با مثبت شدن ارهاش یا فنوتیپDu در نوزاد، مادر کاندیدای تزریق روگام است.
- برای بیماران احتیاجی به انجام تست Du نیست.
گفتنی است که برخی از انواع آنتی D منوکلونال قادر به آگلوتیناسیون مستقیم برخی از انواع فنوتیپ Du هستند و تعجبی ندارد که فردی که قبلاً با استفاده از آنتی D نوع انسانی گروهبندی منفی شده است، هم اکنون ارهاش مثبت گزارش شود.
دکتر حبيبا..گلافشان